
 |
Qu'est-ce que le noyau atomique ? |
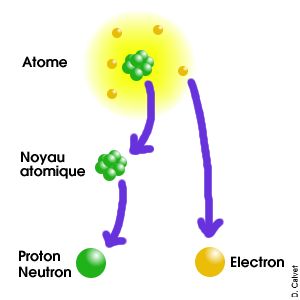 Cette image n'est qu'un schéma illustratif mais n'est en aucune manière une représentation fidèle de la réalité. En particulier, les particules ne sont pas semblables à des billes et l'échelle n'est pas respectée. |
Le noyau atomique est le coeur de l'atome.
Il est situé en son centre, est mille fois plus petit
et contient 99,97% de sa masse. Le noyau contient des nucléons, c'est à dire des protons et des neutrons. Il a donc une charge électrique positive. La cohésion du noyau atomique est assurée par l'interaction forte, qui attire les nucléons entre eux et empêche ainsi les protons de se repousser.
|
 |
Quel est le volume du noyau ? |
Le volume du noyau atomique est proportionnel au nombre de nucléons qu'il contient. Ce volume est de 7,3 10-45m3 fois le nombre de nucléons. Il est donc extrèmement petit. Comme il contient 99,97% de la masse de la matière, sa densité est gigantesque.
|
 |
Qu'est-ce qui lie les nucléons entre eux ? |
|
L'interaction qui agit entre les nucléons n'est qu'un effet
secondaire de l'interaction forte.
En effet, il ne peut pas y avoir d'échange de
gluon entre les
nucléons puisqu'ils n'ont
pas de charge de couleur (ils sont
``blancs''). Ainsi, les nucléons s'attirent dans le noyau
atomique en échangeant des
pions. Les pions sont des mésons. Ils sont donc formés d'un quark et d'un anti-quark. Il existe trois formes de pions :
L'échange de pions neutres ne change pas la nature des nucléons alors que l'échange de pions chargés permet à un proton et un neutron de s'échanger leurs natures. Le schéma ci-contre représente l'exemple d'un proton et d'un neutron qui interagissent en échangeant un pion positif : le proton se transforme en un neutron en émettant un pion positif, lui-même absorbé par un neutron qui devient donc un proton. Le noyau atomique est donc un objet très complexe, qui en plus des nucléons contient aussi des pions sans cesse échangés par ces nucléons. C'est cet échange incessant qui assure la cohésion du noyau.
|
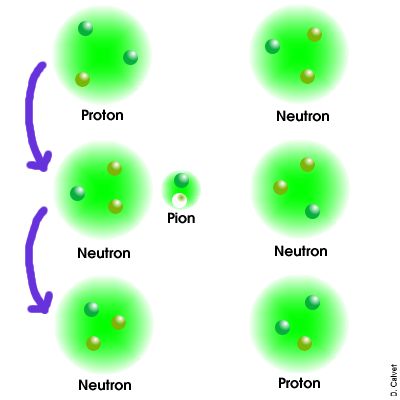 Cette image n'est qu'un schéma illustratif mais n'est en aucune manière une représentation fidèle de la réalité. En particulier, les particules ne sont pas semblables à des billes et l'échelle n'est pas respectée. |
 |
Qu'est-ce que la fission nucléaire ? |
La fission d'un atome correspond à la séparation en deux morceaux du noyau de cet atome, avec en plus quelques neutrons. Les deux atomes restant sont en général radio-actifs.
Un atome peut fissionner soit de manière spontanée si son noyau est trop lourd, soit parce qu'il a été heurté par un neutron. Ainsi, les neutrons émis lors de la fission vont engendrer d'autres fissions, ce qui se traduit par une réaction en chaine. C'est ce processus qui est utilisé dans les réacteurs nucléaires et les bombes A, car la fission s'accompagne de libération d'énergie.
 |
Qu'est-ce que la fusion nucléaire ? |
La fusion de deux atomes apparait lorsque les noyaux de ces deux atomes sont suffisamment proches l'un de l'autre pour fusionner, c'est à dire pour former un unique noyau.
Comme les noyaux ont une charge électrique positive, ils se repoussent mutuellement, ce qui les empêche de fusionner. Si ces atomes sont dans un milieu très chaud, ils auront des vitesses suffisamment élevées pour pouvoir fusionner avant d'être séparés par la répulsion électromagnétique. C'est pourquoi on parle souvent de fusion thermonucléaire. Au coeur du Soleil, la température est suffisamment élevée pour que des réactions de fusion nucléaire aient lieu : c'est ce qui fait briller le Soleil, car ces réactions s'accompagnent de libération d'énergie.
La fusion n'est pas encore utilisée pour produire de l'énergie car il est très difficile de faire un réacteur fonctionnant à la température nécessaire de plusieurs millions de degrés ! Par contre, elle est malheureusement utilisée dans les bombes H.
 |
Qu'est-ce que la radio-activité ? |
Certains atomes sont radio-actifs, c'est à dire qu'ils émettent un rayonnement. En fait, c'est le noyau de ces atomes qui émet ce rayonnement, car ce noyau est instable. Contrairement à ce que beaucoup de gens croient, la radio-activité est un phénomène tout à fait naturel.
On distingue trois types de radio-activité d'origines différentes : les radio-activités α (alpha), β (bêta) et γ (gamma).
 |
La radio-activité α (alpha) |
Un atome radio-actif α émet une "particule α", c'est à dire un noyau d'hélium (en fait deux protons et deux neutrons). Ainsi le noyau, en perdant deux protons, change de nature. Par exemple, un atome de polonium 210 (84 protons et 126 neutrons) devient, par radio-activité α, un atome de plomb 206 (82 protons et 124 neutrons).
L'origine de la radio-activité α est une instabilité globale du noyau de l'atome qui se stabilise en éjectant ces deux protons et deux neutrons.
 |
La radio-activité β (bêta) |
|
La radio-activité β existe sous deux formes :
β+ et β-.
Un atome radio-actif β- émet un
électron et un
anti-neutrino
électronique. Un atome radio-actif β+
émet un anti-électron (ou
positron) et un neutrino électronique.
En plus de cette émission de particules, la nature des nucléons
de ce noyau est modifiée. Ainsi, dans le cas d'une
désintégration β-, un neutron se
change en proton. Dans le cas d'une désintégration
β+, c'est un proton qui se change en
neutron. Le noyau change donc de nature.
|
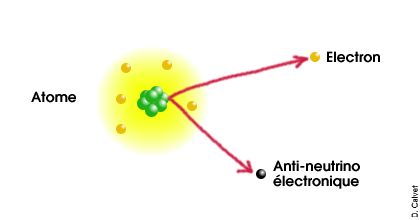 Cette image n'est qu'un schéma illustratif mais n'est en aucune manière une représentation fidèle de la réalité. En particulier, les particules ne sont pas semblables à des billes et l'échelle n'est pas respectée. |
L'origine de la radio-activité β est une désintégration d'un proton ou d'un neutron par interaction faible.
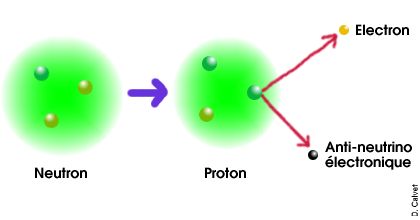 Cette image n'est qu'un schéma illustratif mais n'est en aucune manière une représentation fidèle de la réalité. En particulier, les particules ne sont pas semblables à des billes et l'échelle n'est pas respectée. |
Plus précisément, c'est un des
quarks du
nucléon
qui se désintègre.
Ainsi, dans le cas de la radio-activité β-,
un quark down du neutron se désintègre
en un quark up, un électron et un
anti-neutrino électronique. Il reste donc dans le nucléon
deux quarks up et un quark down, le neutron devient donc un proton.
Dans le cas de la désintégration β+,
un quark up du proton se désintègre en un quark down,
un positron et un neutrino électronique, le proton devient donc
un neutron.
|
 |
La radio-activité γ (gamma) |
Un atome radio-actif γ émet un photon (aussi appelé γ). L'origine de cette radio-activité est une excitation globale du noyau qui se désexcite en émettant ce photon (donc en perdant de l'énergie). Cette excitation initiale du noyau est souvent due à une première désintégration par radio-activité α ou β et la radio-activité γ accompagne donc souvent ces deux premières.
La radio-activité γ ne change pas la nature de l'atome qui la subit, puisque les nombres de protons et neutrons ne changent pas dans le noyau.
 |
Un peu d'histoire... |
La découverte de la radio-activité est très récente, puisqu'elle remonte à la fin du XIXème siècle, et a révolutionné la science. En effet, c'est cette découverte qui a permis de commencer à comprendre la structure des atomes.
En 1896, Henri Becquerel découvre la radio-activité de l'uranium, alors qu'il étudie les rayons X découverts par Röntgen un an plus tôt. Quelques mois plus tard, Marie Sklodowska, qui vient d'épouser Pierre Curie, soutient sa thèse et montre que, comme l'uranium, le thorium est aussi radio-actif. En 1898, Pierre et Marie Curie découvrent un élément beaucoup plus radio-actif, qu'ils appellent le polonium. Puis, ils découvrent un autre élément très radio-actif, la radium, ce qui leur vaut le prix Nobel de physique en 1903. De plus, Marie Curie reçoit le prix Nobel de chimie en 1911 pour sa mise au point d'un procédé permettant d'isoler le radium.
Enfin, en 1934, Irène et Frédéric Joliot-Curie (Irène est la fille de Pierre et Marie Curie) découvrent la radio-activité artificielle. Ils sont récompensés l'année suivante par le prix Nobel de chimie.
 |
Qu'est-ce que la période d'un élément radio-actif ? |
Un élément radio-actif α ou β change de nature à mesure que ses atomes se désintègrent. Ainsi, si on a une quantité d'un certain élément radio-actif, après un certain temps une partie de cet élément aura été transformée en un autre élément, la quantité d'élément de départ aura diminué. Au bout d'un certain temps, il ne restera plus que la moitié de l'élément de départ, ce temps est la période de cet élément.
Par exemple, si on a 10 grammes de polonium 210 au départ, il faudra attendre environ 138 jours pour n'en avoir plus que 5 grammes, on aura alors aussi environ 5 grammes de plomb 206. La période du polonium 210 est donc de 138 jours. Autre exemple, si on a 10 grammes de potassium 40 au départ, il faudra attendre 1,3 milliards d'années pour n'en avoir plus que 5 grammes ! Enfin, la période du carbone 14 est de 5 600 ans. On peut donc voir que les périodes peuvent être très différentes pour différents éléments.
 |
La radio-activité naturelle |
La radio-activité naturelle est très importante mais assez mal connue. C'est probablement une source d'énergie importante qui contribue à maintenir le magma en fusion sous la croûte terrestre (que l'on aperçoit quelque fois en surface sous la forme de lave).
Un corps humain contient environ 20 milligrammes de potassium 40, un élément radio-actif β naturel.
|
La connaissance des proportions naturelles des éléments radio-actifs et de leurs périodes permet de calculer l'âge d'objets qui les contiennent. Cette méthode est largement utilisée pour dater des objets par les archéologues, par exemple en utilisant le carbone 14.
 |
La radio-activité artificielle |
Certains éléments radio-actifs sont naturellement présents dans la nature : par exemple le carbone 14 ou le potassium 40. Cependant, il est aussi possible de créer artificiellement des éléments radio-actifs qui ne se trouvent pas dans la nature, c'est la radio-activité artificielle. Pour cela, il faut bombarder des atomes "naturels" avec des protons ou des neutrons (ou des noyaux d'hélium, les "particules α"). De cette manière, les noyaux des atomes de départ sont modifiés, c'est donc une réaction nucléaire.
 |
Pour en savoir plus... |
Si vous voulez en savoir plus sur la radio-activité, vous pouvez consulter le site suivant: